Los alcanos son moléculas orgánicas formadas por átomos de carbono e hidrogeno, todos los enlaces dentro de las moléculas de alcanos son de tipo simple o sigma.Fórmula general para los alcanos alifáticos(de cadena lineal) es CnH2n+2 y para ciclo alcanos es CnH2n.Tambien reciben el nombre de hidrocarburos saturados.
ESTRUCTURA
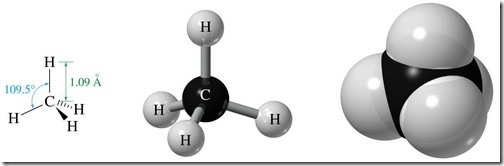
El alcano más simple es el metano CH4.La molécula del metano es un tetraedro prefecto con ángulos de 109.5º.La distancia de enlace C-H es de 1.09 Å,la hibridaciñon sp3 en el átomo de carbono explica la estructura del metano.Cada enlace C-H se forma por solapamiento de un orbital sp3 del carbono con un orbital 1s hidrógeno.
El etano CH3-CH3 está compuesto por dos grupos metilo.Cada átomo de carbono presenta una hibridación sp3 y se une a los átomos de hidrógeno mediante un enlace s formado por solapamiento del orbital 1s del hidrógeno con un orbital sp3 del carbono.Ademas existe un enlace s C-C formado por el solapamiento de un orbital sp3 de un carbono con el otro sp3 del otro átomo de carbono.
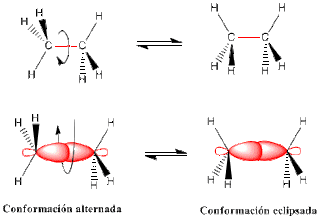
Las conformaciones de un compuesto son las diferentes disposiciones espaciales que pueden adoptar sus átomos por rotación alrededor de un enlace simple C-C. A cada conformación se le denomina "rotámero ó confórmero" y se interconvierten uno en otro por rotación alrededor de un enlace sencillo. Dos de ellas, llamadas conformación alternada y conformación eclipsada.
- Alternada: es aquella en la que los enlaces C-H(R) están lo más alejados posibles.
- Eclipsada: es aquella donde los enlaces C-H (R) están lo más cercano posible.
ETANO
BUTANO
NOMENCLATURA
Según la IUPAC:
- Se designan por el sufijo -ano.
- Los prefijos de los cuatro primero son metano,eteno,propano,butano.
- A partir del quinto elemento se emplea el prefijo griego.
- El isómero de cadena lineal,no ramificada,se designa anteponiendo la letra n a su nombre.
- En cadenas ramificadas,se nombra la mas larga.
- Los grupos sustituyentes reciben el nombre alquilo.
Ejemplos:
CH4 metano
CH3 – CH3 etano
CH3 – CH2 – CH3 propano
CH3 –CH2 –CH2 – CH3 butano
l-4-etilnon2,4-dimetiano
3,4-dietilheptano
PROPIEDADES FÍSICAS
- Los cuatro primeros términos de la serie son gases; del propano al heptano son líquidos; del octadecano en adelante son sólidos de aspecto céreo.
- Los puntos de ebullición crecen al aumentar el peso molecular en los n-alc anos.En los isómeros disminuye al aumentar la ramificación.
- El punto de fusión también aumenta con el peso molecular en los n-alcanos en tanto que los isómeros no hay una variación regular.
- Son insolubles en agua.
- Los ciclo alcanos presentan mayor punto de fusión,ebullición y densidad.
SÍNTESIS
1).CONSERVANDO LA LONGITUD DE LA CADENA
- Hidrogenación catalítica de alquenos (Adams): esta reacción se lleva acabo,calentando a reflujo y con agitación un alqueno en presencia del catalizador Pd o Pt metálico finamente dividido,que tiene hidrógeno adsorbiendo en su superficie.
- Reducción de halogenuros de alquilo: esta reacción se llama de reducción por que se esta reemplazando un átomo muy electronegativo como es el Cl (3,0) por uno con electronegatividad semejante a la del carbono (2,5) como es el átomo de hidrógeno(2,25) y el carbono entonces comparte en un grado mayor los electrones del enlace.
- Usando el reactivo de Grignard: el reactivo de Grignard se prepara a partir de un halogenuro de alquilo,usando éter anhidro como solvente en el que se disuelve el magnesio metálico.Se obtiene de esta manera un complejo organometálico donde la parte orgánica es una base muy fuerte,de un pKa de alrededor de 40.
2). REDUCCIÓN DE COMPUESTOS CARBONÍLICOS.(C=O)
- Método de Clemmensen (Medio ácido): este método reduce el compuesto carbonílico con Zinc amalgamado,obtenido al tratas previamente en el Zn metálico con una disolución acuosa de una sal de mercurio.
- Método de Wolf-Kishner (Medio alcalino): en este método se calienta fuertemente y a reflujo el aldehído o la cetona con una solución alcalina de hidracina. (NH2-NH2)
- Método de los tioacetales (Medio neutro): estos tres métodos de reducción son complementarios.Pueden ser usados específicamente cuando se corre el riesgo de efectar algún grupo funcional en alguna de las moléculas involucradas por acción del reactivo utilizado en la reducción.
3). ALARGANDO LA CADENA
- Método de Wurtz: este método sirve para sintetizar alcanos simétricos,es decir, solo debe usarse un halógenuro de alquilo en cada reacción.
Al utilizar una mezcla de halógenuros se obtiene como producto una mezcla de alcanos con la desventaja de disminuir el rendimiento de la reacción.
- Método electrolítico de Kolbe: este método también sirve para obtener un alcano simétrico, y al usar dos ácidos en la reacción presenta las mismas desventajas que el método de Wurtz.El rendimiento en el producto que interesa pasar a ser menor que un 30%.
- Método de Corey-Hause: es un excelente método para obtener cualquier alcano simétrico o asimétrico.No presenta ninguna de las desventajas de los otros métodos anteriores.
PROPIEDADES QUÍMICAS
- Reacciones con oxígeno: todos los alcanos reaccionan con oxígeno en una reacción de combustión,si bien se torna más difícil de inflamar al aumentar el número de átomos de carbono.La ecuación para la combustión completa es: CnH2n+2 + (1,5n+0,5)O2 → (n+1)H2O + nCO2 En ausencia de oxígeno suficiente,puede formarse monóxido de carbono o inclusive negro de humo, como se muestra a continuacón: CnH(2n+2) + ½ nO2 → (n+1)H2 + nCO,por ejemplo metano:CH4 + 2O2 → CO2 + 2H2O CH4 + O2 → C + 2H2O.
- Reacciones con halógenos:los alcanos reaccionan con halógenos en la denominada reacción de halogenación radicalaria.Los átomos de hidrógeno del alcano son reemplazados progresivamente por átomos de halógeno.Los radicales libres son las especies que participan en la reacción, que generalmente conducen a una mezcla de productos.
- Gracking: la pirolisis o craqueo térmico es la fragmentacion de alcanos de cierto tamaño en otros de menor tamaño a elevadas temperaturas
- Isomeración y reformado: son procesos en los que los alcanos de cadena lineal son calentados en presencia de un catalizador de platino.En la isomeración,los alcanos se convierte en sus isómeros de cadena ramificada.
- Otras reacciones: Los alcanos reaccionan con vapor en presencia de un catalizador de níquel para producir hidrógeno.Los alcanos pueden ser clorosulfonados y nitrados,aunque ambas reacciones requieren condiciones especiales.La fermentación técnica.En la reacción de Reed, el dióxido de azufre y cloro convierten a los hidrocarburos en cloruros de sulfonilo, en un proceso inducido por luz.
APLICACIONES INDUSTRIALES
La fuente comercial más importante para los alcanos es el gas natural y el petróleo.El gas natural contiene principalmente metano y etano,pero también algo de propano y butano: el petróleo es una mezcla de alcanos líquidos y otros hidrocarburos.